材料化学-《无机化学》专升本考试大纲
《无机化学》专升本考试大纲
课程性质:专业基础课(必修)
适用专业:材料化学
考试对象:材料化学专业专升本学生
课程学时:56学时/3.5学分
二、课程考试目的及考核目标
以材料化学专业本科生人才培养方案中对本科生的基础知识能力要求为目标,无机化学课程 考试旨在考察学生对无机化学中的基本原理、基本理论及基础知识的掌握程度,为后续专业课程的学习打下坚实基础,为从事专业相关工作提供知识及能力支撑。
三、考试范围
第一章 化学基础知识
(一)考试内容
1、混合气体分压定律
2、稀溶液依数性及应用
3、溶液浓度表示方法
(二)考试要求
掌握理想气体状态方程及混合气体分压定律、掌握稀溶液的依数性及应用,掌握溶液浓度表示方法,熟悉溶液饱和蒸气压,明确学习本课程对于未来其它化学课程及专业课程学习的重要作用,激发学生学习的兴趣与热情,为以后各章学习打下基础。
第二章:化学热力学基础
(一)考试内容
1、状态函数性质
2、盖斯定律
3、焓、熵、吉布斯自由能的含义及化学反应过程中的反应焓、反应熵、吉布斯自由能的求解
4、利用吉布斯自由能判断反应进行方向及逆转温度
(二)考试要求
掌握状态函数的基本概念,掌握化学反应进度的概念及反应进度求解,掌握盖斯定律,掌握标准生成热的定义,掌握焓、熵、吉布斯自由能的含义及化学反应过程中的反应焓、反应熵、吉布斯自由能的求解,利用吉布斯自由能判断反应进行方向及逆转温度,熟悉热力学第一、第二、第三定律,熟悉化学反应的热效应,理解燃烧热,理解可逆途径。
第三章:化学反应速率
(一)考试内容
1、反应速率的概念、速率方程、反应级数及速率常数
2、反应机理
3、反应物浓度与时间的关系
4、温度对反应速率的影响
5、催化剂与催化反应
(二)考试要求
反应速率的概念、速率方程的表示、反应级数及速率常数求解,掌握反应物浓度与时间的关系求解,掌握温度对反应速率的影响,熟悉催化剂对反应的影响,了解反应机理及反应速率理论。
第四章:化学平衡
(一)考试内容
1、化学反应等温式
2、平衡常数的相关计算
3、用平衡常数判断化学反应方向
4、化学平衡的移动
(二)考试要求
掌握标准平衡常数的定义,掌握用平衡常数判断化学反应方向的方法,掌握化学反应等温式子(特霍夫等温方程式),掌握化学平衡的移动及相关计算,熟悉平衡转化率,了解经验平衡常数。
第五章:原子结构和元素周期律
(一)考试内容
1、核外电子运动状态的描述(四个量子数)
2、多电子原子的能级、原子核外电子排布规律
3、元素基本性质(原子半径、电离能、电子亲和能及电负性)的周期性
(二)考试要求
掌握四个量子数及原子和外电子排布规律,掌握元素周期表的分区,掌握原子半径、电负性随周期变化的规律,熟悉核外电子运动状态的图形描述,了解近代原子结构的确立及微观粒子运动的特殊性。
第六章:分子结构和共价键理论
(一)考试内容
1、共价键理论及共价键的基本性质
2、杂化轨道理论与分子空间构型
3、价层电子互斥论与分子空间构型
(二)考试要求
掌握价键理论基本知识及共价键基本性质,掌握杂化轨道理论基本知识,熟悉价层电子互斥论。
第七章 晶体结构
(一)考试内容
1、分子间作用力
2、离子晶体和离子键
3、次级键及氢键
(二)考试要求
掌握分子间作用力的分类和特点,熟悉离子键的性质,熟悉氢键及次级键,了解离子的特征和离子晶体,了解离子极化及离子极化对化合物性质的影响。
第八章 酸碱解离平衡
(一)考试内容
1、一元弱酸弱碱的解离平衡
2、多元弱酸弱碱的解离平衡
3、缓冲溶液构成、性质及配置计算
4、盐的水解
(二)考试要求
掌握一元弱酸、弱碱的解离平衡及计算,掌握多元弱酸、弱碱的解离平衡及计算,熟悉缓冲溶液的配制计算,熟悉盐的水解与水解平衡计算,了解强电解质溶液理论,了解酸碱电子论及酸碱溶剂论。
第九章 沉淀溶解平衡
(一)考试内容
1、溶度积常数及计算
2、溶度积与溶解度的关系及换算
3、溶度积原理
4、沉淀的生成计算及应用
(二)考试要求
掌握溶度积常数基本概念及求解计算,掌握溶度积原理,掌握溶度积和溶解度的关系及相互换算,熟悉沉淀的生成计算及应用,了解沉淀的溶解与转换。
第十章 氧化还原反应
(一)考试内容
1、电极电势及电动势
2、电池反应热力学
3、电动势和标准电动势的关系(能斯特方程)
4、影响电极电势的因素
(二)考试要求
理解化合价和氧化数,掌握原电池表示方法及电池符号书写,掌握电极电势和电动势,掌握电池反应热力学及能斯特方程的应用,熟悉影响电极电势的因素,了解化学电源和电解,了解图解法讨论电极电势。
第十一章 配位化学基础
(一)考试内容
1、配合物命名
2、配合物的构型、中心价层轨道的杂化
3、配合物的稳定性
(二)考试要求
掌握配位化合物的命名,掌握配合物的价键理论,熟悉配合物的稳定性,了解配位化合物的晶体场理论。
四、考试方式及时间
1、考试方式:闭卷
2、考试时间:120分钟
1、单项选择题 30分
2、填空题 20分
3、判断题 10分
4、简答题 16分
5、计算题 24分
说明:每题型的分值可根据实际情况稍有调整。
六、教材与参考书目
1、教材
《无机化学》上册,第四版,宋天佑、程鹏等人编写,高等教育出版社,2019.
2、参考书目
(1)《无机化学》,第六版,孟长功主编,高等教育出版社,2018.
(2)《无机及分析化学》,第五版,南京大学编写组,高等教育出版社,2015.
附录:题型举例
一、 单项选择题 (每小题2分,共30分)
1. 在一定温度下,某容器中充满质量相同的下列气体,其中分压最小的气体是( )。
A. O2 (g) B. He (g) C. N2 (g) D. CO2 (g)
2. 升高温度可以增加反应速率,最主要是因为( )。
A. 增加了分子总数 B. 增加了活化分子的百分数
C. 降低了反应活化能 D. 促进了平衡向吸热方向移动
3. 比较F,Cl,Br三种元素的电负性和原子半径大小的顺序,正确的是:( )。
A.电负性F>Cl>Br 原子半径F<Cl<Br
B.电负性F<Cl<Br 原子半径F<Cl<Br
C.电负性F<Cl<Br 原子半径F>Cl>Br
D.电负性F>Cl>Br 原子半径F>Cl>Br
4. BeCl2分子中Be原子采取sp杂化的形式与Cl原子成键,其空间构型为( )。
A. 直线型 B. 平面三角形 C. 正四面体 D. 正八面体
5. 下列物质中可形成原子晶体的是( )。
A. NaCl B. CO2 C. SiO2 D. H2O
6. 共价键最可能存在于( )。
A. 金属原子之间 B. 非金属原子之间
C. 金属原子和非金属原子之间 D. 电负性相差很大的元素的原子之间
7. 欲配制pH=9.0缓冲溶液,应选用下列何种弱酸或弱碱和它们(强酸或强碱)的盐来配制( )。
A、NH2OH (Kb=1.0×10-9) B、NH3·H2O (Kb=1.8×10-5)
C、HAc (Ka=1.8×10-5) D、HNO2 (Ka=5.0×10-4)
8. [Co(SCN)4]2-离子中钴的价态和配位数分别是( )。
A. -2,4 B. +2,4 C. +3,2 D. +2,12
9. 已知某元素+2价离子的电子排布式为1s22s22p6,该元素在周期表中所属的分区为( )。
A. s区 B. d 区 C. ds 区 D. p 区
10. 下列各种含氢的化合物中含有氢键的是( )。
A. HF B. CH4 C. HCOOH D. H3BO3
11. 酸性介质中,如果jy MnO4-/ MnO42- =0.56 V,jy MnO42-/ MnO2 =2.26 V,
则jy MnO4-/ MnO2=( )。
A. 2.815 B. 1.675 C. 1.695 D. 无法判断
12. 核外某电子的主量子数n=4,它的角量子数l可能的取值有( )。
A. 1个 B. 2个 C. 3个 D. 4个
13. 下面的叙述中,正确的是( )。
A. 溶度积大的化合物溶解度肯定大
B. 向含AgCl固体的溶液中加适量的水使AgCl溶解又达平衡时,AgCl溶度积不变,其溶解度也不变
C. 将难溶电解质放入纯水中,沉淀溶解达平衡时,电解质离子浓度的乘积就是该物质的溶度积
D. AgCl水溶液的导电性很弱,所以AgCl为弱电解质
14. 把醋酸钠固体加到醋酸的稀溶液中,则pH值将( )。
A. 增高 B. 下降 C. 先下降后增高 D. 先增高后下降
15. 关于催化剂的作用,下列叙述中不正确的是( )。
A. 能够加快反应的进行
B. 在几个反应中,能选择性地加快其中一、二个反应
C. 能改变某一反应的正逆向速率比值
D. 能缩短反应达到平衡的时间,但不能改变某一反应物的转化率
二、 填空题(每空1分,共20分)
1. 在HAc溶液中,加入NaCl,HAc的解离度 ① ,这种效应属于 ② 。
2. 原子序数为20的元素,其基态原子的核外电子排布为 ③ ,该元素位于周期表第 ④ 周期 ⑤ 族,该元素是 ⑥ 。
3. 孤立系统的任何自发过程,系统的熵总是 ⑦ (填增加、减小或不变)。
4. 原电池中, ⑧ 极是电子流出的一极,发生氧化反应。
5. 在质子理论中,凡是能给出质子的是 ⑨ ,能结合质子的是 ⑩ 。
6. K[PtCl3(NH3)]命名为 ⑪ ;中心离子为 ⑫ ,配体
为 ⑬ 和 ⑭ ,配位数为 ⑮ 。
7. 将0.845g NaCl溶于200g水中配制成溶液,该溶液的质量摩尔浓度是 ⑯ , 物质的量浓度是 ⑰ 。
8. 稀溶液的依数性主要包括蒸气压下降、 ⑱ 、 ⑲ 及溶液渗透压。
9. 在常温下,水的离子积常数为 ⑳ 。
三、 判断题(每小题1分,共10分)
1. 热力学能、焓、熵以及热和功都是状态函数。( )
2. △rS为正值的反应均是自发反应。( )
3. 质量摩尔浓度是指单位质量溶液中所含溶质的物质的量。( )
4. 色散力作用只存在于非极性分子之间。( )
5. 在2SO2(g)+O2(g)2SO3(g)的反应中,在一定温度和一定浓度下,不论是否使用催化剂,只要反应达到平衡,产物的浓度总是相等的。( )
6. 电负性综合地表征了原子得失电子的能力。( )
7. 当可逆反应达到平衡时,反应即停止,且反应物和生成物的浓度相等。( )
8. 非极性分子中可能有极性键。( )
9. 某一元酸越强,则其共轭碱越弱。( )
10. 对于一可逆放热反应,升高温度,反应速率降低。( )
四、解答题(每小题4分,共16分)
1. 冬天在雪地里撒盐,雪就融化了,试解释其原因。
2. 某溶液中c(Cl-)= c(Br-) = c(I- )=0.01 mol.cm-3,慢慢滴加AgNO3溶液,会有什么现象?已知:Kspө(AgCl) =1.77 ×10-10 ,Kspө(AgBr) =5.35 × 10-11,Kspө(AgI) =8.51 × 10-17
3. 阐述原子核外电子排布规律。
4. 为什么共价键既具有饱和性又具有方向性?
五、计算题(每小题8分,共24分)
1. 已知298K时,BaCO3分解反应如下:
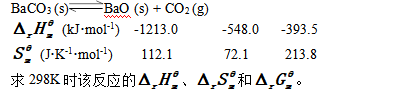
2. 计算0.10 mol/ dm-3 HCN溶液的c(H+)和解离度a。(已知HCN的Kθa=6.2×10-10)。
3. 保持标准氢电极中H2的压强不变,将标准浓度的盐酸换成0.10 mol/dm-3醋酸,求此时氢电极的电极电势。已知醋酸的Kθa=1.8×10-5。











